
ここからコンテンツです。

"Islands" of Cell Membrane Components
Proteoliposome fusion and domain formation in an artificial lipid bilayer membrane By Ryugo Tero
Research conducted by Ryugo Tero at Toyohashi University of Technology in collaboration with Tohoku University elucidated the fusion process of proteoliposomes with an artificial lipid bilayer and the mechanism behind this process. In addition, it was also discovered that the domains composed of all cell membrane components exist as “islands” that were isolated from the artificial membrane. These findings will lead to further understanding of the functions of membrane proteins, which are an important target of drug development.
All exchanges of materials, signals, and energy in and out of cells to maintain biological activity are performed through membrane proteins and lipids on the cell membrane. Since these processes have a strong influence on neurotransmission and metabolism, they are important research targets in the fields of biology, medicine and drug development. Components of the cell membrane including membrane proteins and lipids are generally derived from cultured cells, and spherical structures of lipid bilayer membranes including these derived proteins are called proteoliposomes.
Because membrane proteins maintain their structure and functions by remaining within a lipid bilayer, artificial lipid bilayers are commonly used for measuring the functions of membrane proteins without affecting their activity. After the fusion of proteoliposomes with an artificial lipid bilayer, the cell membrane environment must be maintained; experimental conditions for this fusion have been derived through accumulated empirical evidence.
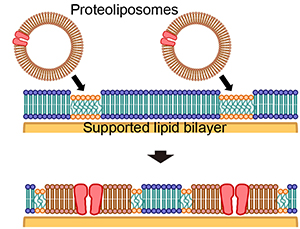
The research group led by Ryugo Tero, associate professor at Toyohashi University of Technology in collaboration with Tohoku University, discovered that “islands” made of cell membrane components grow within an artificial lipid bilayer through observation of the fusion of proteoliposomes derived from cultured cells with an artificial lipid bilayer. Furthermore, they also found that the artificial lipid bilayer and proteoliposomes do not mix, and that membrane proteins and lipids inside the cell membrane formed isolated domains away from the artificial lipid bilayer. The size and distribution of these “islands” were found to be dependent on the type of cells that the proteoliposomes were derived from. In addition, they also clarified that microdomains (domains with a specific composition of lipids) serve as a specific site for the fusion of proteoliposomes.

Ryugo Tero says that "we were very surprised when we saw the spreading of dark islands made of cell membrane components in a sea of the bright artificial lipid bilayer labeled with fluorescence. The phosphatidylcholine, phosphatidylethanolamine and cholesterol used in this study to make the artificial lipid bilayer are major components in the cell membrane. Although proteoliposomes also contain these same lipid components, it was very strange to find that they did not mix with each other. This result provides very valuable information in that the cell membrane components are not being mixed into the surroundings and dispersed, but form clusters in the artificial lipid bilayer. By using this experimental technique, for example, we could also observe the phenomenon of collaborative interaction between multiple proteins and lipids in the cell membrane".
Professor Ayumi Hirano-Iwata at Tohoku University says that "In our study of ion channels, the most important factor affecting the success rate of measurements is whether proteoliposomes fuse with an artificial lipid bilayer or not. We had been searching for the right experimental conditions each time we changed the type of cells or membrane proteins. By understanding the membrane fusion process and its mechanism as clarified by this study, the efficiency of our experiments will be greatly improved".
The research group believes that the fusion process of proteoliposomes and its mechanism elucidated by this research will accelerate the research of ion channels and membrane proteins which are important targets of drug development. In addition, the “islands” made of cell membrane components will provide useful information for understanding complex biological reactions in which multiple proteins and lipids are involved, as well as for developing high-throughput membrane protein screening technology.
This work was supported by CREST, Japan Science and Technology Agency (JST) Grant Number JPMJCR14F3; Japan Society for the Promotion of Science KAKENHI Grant Numbers JP15H03768, JP15H00893, and JP15H03822; A-STEP, JST; and Research Foundation for Opto-Science and Technology.
Reference
Ryugo Tero, Kohei Fukumoto, Toshinori Motegi, Miyu Yoshida, Michio Niwano & Ayumi Hirano-Iwata (2017). Formation of Cell Membrane Component Domains in Artificial Lipid Bilayer, Scientific Reports, 7(1), 17905.
https://doi.org/10.1038/s41598-017-18242-9
細胞膜成分の「島」を発見
人工脂質二重膜へのプロテオリポソームの融合とそのしくみBy 手老 龍吾
豊橋技術科学大学の手老龍吾准教授は東北大学と共同で、人工脂質二重膜へのプロテオリポソームの融合過程とそのしくみを明らかにしました。また、細胞膜成分を全て含む領域が、人工膜から独立した「島」として存在する様子を初めて見出しました。これらの知見は、重要な創薬ターゲットである膜タンパク質の働きを理解し、そのための実験手法を開発することにつながります。
生命活動に必要な物質・情報・エネルギーの細胞内外でのやり取りは全て、細胞膜に存在する膜タンパク質と脂質を通して行われています。これらは神経伝達や代謝などに深く関わることから、生物学・医療・創薬分野での重要な研究対象です。膜タンパク質と脂質を含む細胞膜の成分は、培養細胞から取得するのが一般的で、取得したタンパク質を含む脂質二重膜の球状構造体がプロテオリポソームです。
膜タンパク質は脂質二重膜内に存在することで正しい構造と機能を保つため、膜タンパク質の働きを損なわずに計測するには人工的に作製した脂質二重膜が用いられます。細胞膜の環境を保ちつつ、プロテオリポソームを人工脂質二重膜に融合させる必要がありますが、そのための実験条件は経験的な積み重ねで得られてきました。
手老龍吾准教授と東北大学の共同研究グループは、培養細胞から取得したプロテオリポソームが人工脂質二重膜に融合する過程をその場観察することで、人工脂質二重膜中に細胞膜成分で出来た「島」が成長することを初めて見出しました。さらに、人工脂質二重膜とプロテオリポソームは混ざり合わず、細胞膜内の膜タンパク質や脂質は人工脂質膜から分離して存在することが分かりました。この「島」の大きさと分布は、プロテオリポソームを取得する細胞の種類に依存することが分かりました。また、研究グループは人工脂質二重膜内に存在する微小ドメイン(特定の組成の脂質が集合した領域)が、プロテオリポソームの融合を起こす特別な場所として働いていることを明らかにしました。
手老龍吾准教授は「蛍光標識した明るい人工脂質二重膜の海の中に、真っ黒な細胞膜成分の島が広がっていく様子を見た時は、とても驚きました。この研究で人工脂質二重膜を作るために使ったフォスファチジルコリン(phosphatidylcholine)、フォスファチジルエタノールアミン(phosphatidylethanolamine)、コレステロールは、細胞膜内にも主要な成分として含まれています。プロテオリポソームにもこれらの脂質は含まれているはずなのに、なぜ両者が混じり合わないのか、とても不思議です。細胞膜内の成分が周囲と混ざって分散せずに、集まっているということはとても貴重な情報です。例えば細胞膜内の複数のタンパク質や脂質が協働する現象も、この実験手法を用いて調べられるということです。」と話しています。
共同研究者である東北大学の平野愛弓教授は、「私達がイオンチャネルの研究を行う上で、プロテオリポソームが人工脂質二重膜に融合するかどうかは計測の成功率に一番強く関わる要因です。これまでは細胞や膜タンパク質の種類を変えるたびに手探りで実験条件を探していました。この研究で膜融合の過程としくみが明らかになったことで、実験の効率を大きく向上させることにも繋がります。」と話しています。
本研究成果によって解明されたプロテオリポソームの融合過程とそのしくみが、創薬ターゲットとして重要なイオンチャネルや膜タンパク質の研究を加速させると研究グループは信じています。さらに、細胞膜成分で作られた「島」は、複数のタンパク質や脂質が関わる複雑な生体反応を理解したり、高効率な膜タンパク質スクリーニング技術を開発したりするのに役立つと期待されます。
本研究は、科学技術振興試行(JST), CREST, JPMJCR14F3、日本学術振興会(JSPS)科研費JP15H03768, JP15H00893, JP15H03822、JST, A-STEP、光科学技術研究振興財団からの支援を受けて行われました。
Researcher Profile

| Name | Ryugo Tero |
|---|---|
| Affiliation | Department of Environmental and Life Sciences |
| Title | Associate Professor |
| Fields of Research | Surface physical chemistry |
ここでコンテンツ終わりです。
