

Melanopsin DNA aptamers can regulate the input signals of mammalian circadian rhythms by altering the phase of the molecular clock
Wake up refreshed in the morning with DNA aptamer Melapts Rika Numano
DNA aptamers of melanopsin that can manipulate circadian rhythms were developed by a team comprising members from Toyohashi University of Technology and the National Institute of Advanced Industrial Science and Technology (AIST).
DNA aptamers can specifically bind to biomolecules to modify their function, potentially making them ideal oligonucleotide therapeutics. We screened the DNA aptamer melanopsin (OPN4), a blue light photopigment in the retina that plays a key role in the use of light signals to reset the phase of circadian rhythms in the body’s central clock.
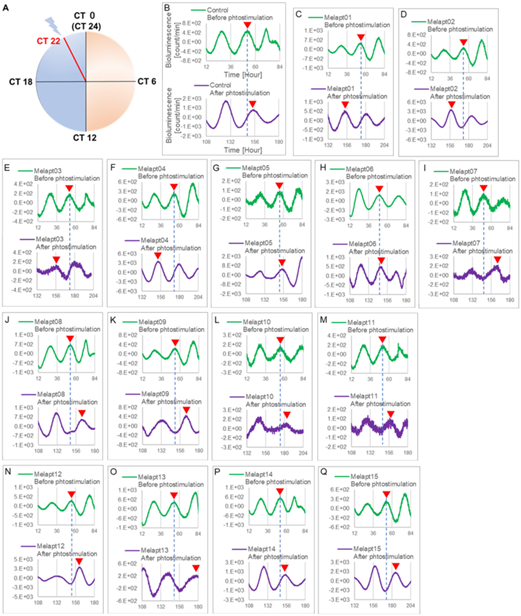
First, 15 DNA aptamers of melanopsin (Melapts) were identified following eight rounds of the Cell-SELEX method using cells expressing melanopsin on the cell membrane. Subsequent functional analysis of each Melapt was performed in a fibroblast cell line stably expressing both Period2:ELuc and melanopsin by determining the degree to which they reset the phase of mammalian circadian rhythms in response to blue light stimulation. Period2 rhythmic expression over a 24-hour period was monitored in Period2:ELuc: thymidine kinase (TK):OPN4 stable fibroblasts expressing melanopsin. At subjective dawn, four Melapts were observed to advance their phase by >1.5 hours, whereas seven Melapts delayed their phase by >2 hours. A few Melapts caused a phase shift of approximately 2 hours, even in the absence of photostimulation, presumably because Melapts can only partially affect input signaling for the phase shift. Additionally, a few Melaps-induced phase shifts in Period1::luc transgenic (Tg) mice were used to monitor circadian rhythms by Period1 rhythmic expression.
These DNA aptamers may have the capacity to affect melanopsin in vivo. In summary, Melapts aptamers can successfully regulate the input signal and the shifting phase (both phase advance and phase delay) of mammalian circadian rhythms in vitro and in vivo.
Indirectly improving the sleep–wake cycle by manipulating the ability of melanopsin to input signals to the central body clock would be socially and economically advantageous.
Melanopsin is a photoreceptor protein expressed in retinal ganglion cells that absorbs blue light with a maximum absorbance of 477 nm. Melanopsin is known to play an important role in resetting the phase of the mammalian circadian clock by means of blue light and the rhythmic expression of clock genes, such as Period1,2 (Per1,2). The phase of the molecular circadian clock is reset by and depends on the timing of light stimulation and the transient induction of Per1 by the melanopsin photoreceptor (Fig. 1). Recently, antagonists of melanopsin acquired via chemical screening of chemical libraries primarily contribute to delaying the rhythm phase.
In this study, we used the cellular systematic evolution of ligands by the exponential enrichment (Cell-SELEX) method to identify DNA aptamers (single-stranded DNA; ssDNA) that cause melanopsin to shift the phase of circadian rhythms. In total, 15 types of melanopsin aptamers (Melapts 1–15) were analyzed to assess their ability to shift the phase of Per2::ELuc bioluminescent oscillations in Per2:ELuc:TK:Mel stable cells, in which a bioluminescent reporter follows the Per2 promoter region controlling an enhanced green-emitting luciferase from Pyrearinus termitilluminans, with melanopsin overexpressed under the control of the thymidine kinase (TK) promotor. In these stable fibroblast cell lines, the signaling pathway is incorporated into a fibroblast cell that mimics the signaling pathway from the retina to the central master clock (suprachiasmatic nucleus or nuclei: SCN) by melanopsin (Fig. 2).
DNA aptamers are short, single-stranded RNA/DNA molecules that can bind selectively to specific targets, proteins, peptides, and other molecules and can be used clinically to switch the function of target molecules. The main advantages of these aptamers include their high target specificity, lack of immunogenicity, and ease of synthesis.
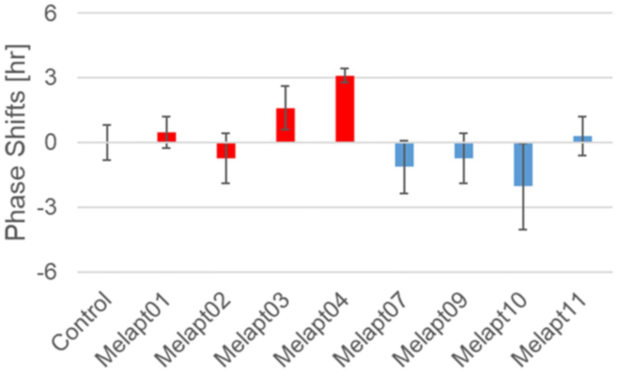
Among the 15 DNA aptamers of melanopsin (Melapts), four Melapts induced a phase advance and seven Melapts induced a delay in circadian rhythms (by >1.5 h and > 2 h, respectively) in the Per2::ELuc cell line. A few Melapts induced phase shifts of approximately 2 h, even in the absence of photostimulation in vitro.
Melapt04 and Melapt10 induced a phase advance or delay of the circadian clock by approximately 3 hours, respectively, at both CT22 and CT8 during the photo signal input process. This suggests that Melapt04 regulates the phase of circadian rhythms and facilitates falling asleep and waking, mainly via phase advance (Fig. 3). Two Melaptes exist that advance and delay the phase shift in the same direction, regardless of the timing of the photostimulus. However, the three Melaptes advanced and delayed the phase shift in opposite directions at dawn and dusk. Therefore, these Melapts are expected to be useful for regulating the phases of rhythms (Fig. 4,5).
We performed in vivo experiments similar to the in vitro experiments to investigate whether Melapt binding to melanopsin in the retina projecting to the SCN affected the phase shifts of the central clock in the SCN. Per1::luc transgenic mice: mice in which the Per1::luc recombinant gene was inserted into the genome of all cells. Per1::luc is a recombinant gene in which the Per1 promoter region is followed by a luciferase enzyme derived from fireflies as a reporter to monitor circadian rhythms (Fig. 6).
Eight types of Melapt-causing phase-shift responses in Per2 expression rhythms in the in vitro experiments were injected into the bulbs of the eyes of Per1::luc Tg mice at CT22 (Fig. 3). Melapt01, Melapt03, Melapt04, Melapt07, Melapt09, and Melapt10 displayed phase-shift abilities similar to those of Per2:ELuc:TK:Mel stable cells: in vivo and in vitro.
The effect of Melapt on phase shift in in vivo experiments can be predicted from in vitro experiments. In addition, the total phase shifts were limited to 3 hours in intact animals, regardless of the extent of advance or delay by Melapts in Per2:Eluk:TK:Mel cells.
In summary, Melapts were able to regulate input signals and phase shifts to achieve both phase advance and phase delay in mammalian circadian rhythms in vitro and in vivo.
Melapts could contribute to future research focused on resetting circadian clock phases. In addition, it could help us better adapt to modern social life cycles, allow crops and domestic animals to be enhanced for greater productivity, and help shift workers overcome social jet lag by adjusting the phases of the circadian clock. These Melapts could contribute to resetting the phase of the circadian clocks in photic input pathways.
This study was supported by research funding from TechnoPro Inc., TechnoPro R&D Company, and the Program to Foster Young Researchers in Cutting-edge Interdisciplinary Research (RN). Funding for Kiban Scientists (to RN 24K15724, 21H02083 and 20H00614) was obtained from the Japan Society for the Promotion of Science (JSPS), Mitsubishi Science Foundation (to RN), and a Research Grant for Science and Technology Innovation at Toyohashi University of Technology (to RN). This study was also supported by the Ministry of Education, Culture, Sports, Science, and Technology of Japan (YN 21H02083).
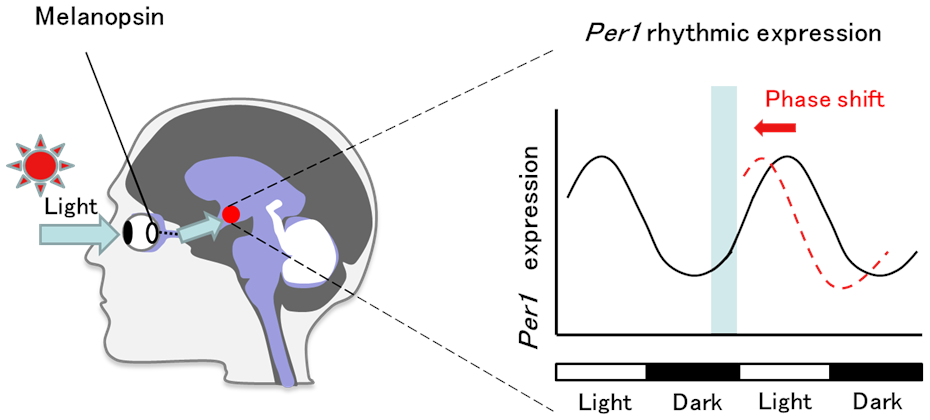
Melanopsin, a blue photoreceptor in retinal cells, receives blue light each morning and transmits the signal via the nerves of the eye to the SCN, the circadian rhythm central pacemaker. The photo stimulation resets the phase of the circadian rhythms every morning and synchronizes one's own rhythm to the earth's light-dark cycle.
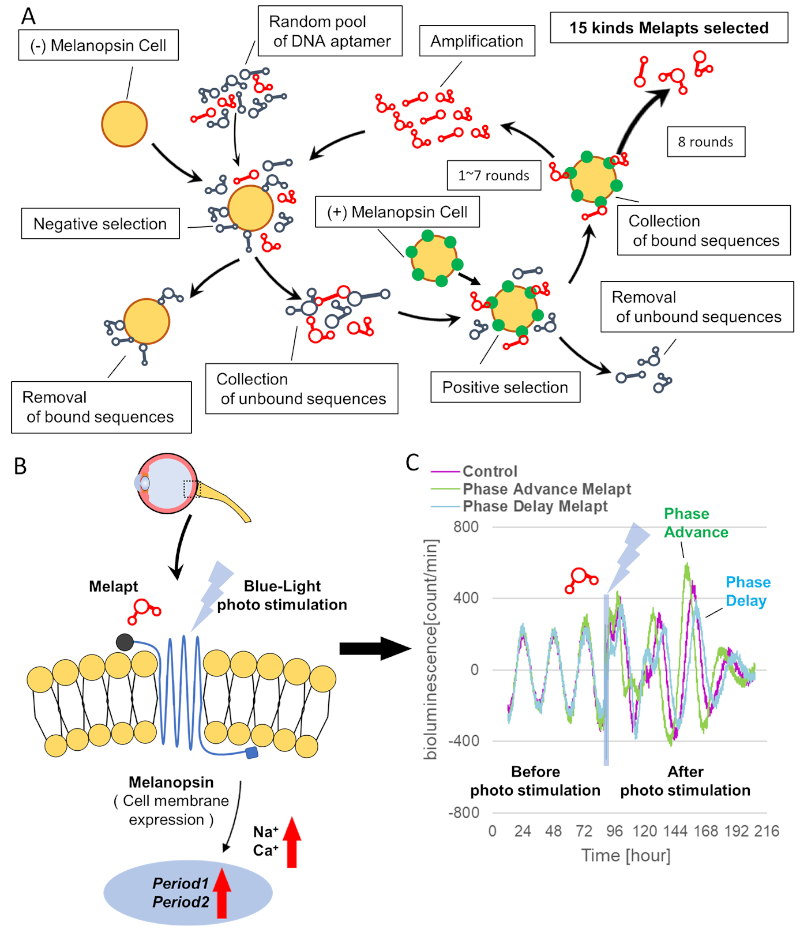
A) Subjective light period from CT0-12, subjective dark period from CT12-0, and a blue light indicate photostimulation at CT22.
B) Per2:ELuc emission upon adding PBS and blue-light. C–Q) Per2:ELuc emission upon adding Melapt01-Melapt15. Upper row (green), Per2:ELuc emission before the addition of Melapt observed for 3 d. Lower row (purple), A red triangle indicates the peak.
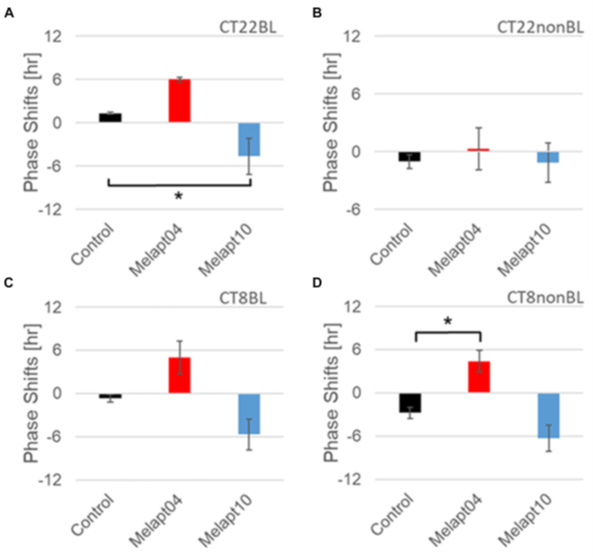
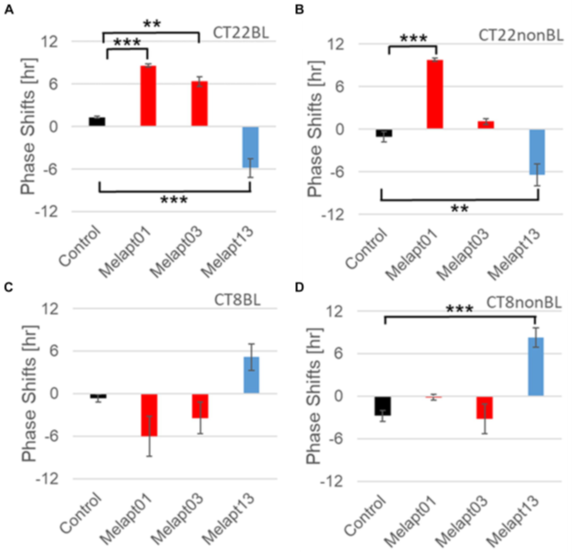
Phase shifts following injection of Melapts into bulbus oculi with LED light stimulus at subjective dawn (CT22). SCN slices were obtained from mice injected with Melapts, and bioluminescence was observed for approximately 5 d. n = 3, *p < 0.05, Tukey–Kramer test
Reference
“Melanopsin DNA aptamers can regulate input signals of mammalian circadian rhythms by altering the phase of the molecular clock”
Kazuo Nakazawa, Minako Matsuo,Yo Kikuchi,i,Yoshihiro Nakajima,Rika Numano
Frontiers in Neuroscience, Sec. Sleep and Circadian Rhythms, Volume 18, 2024
https://doi.org/10.3389/fnins.2024.1186677
時計の針を前に後ろにずらす核酸アプタマー
沼野 利佳豊橋技術科学大学次世代半導体・センサ科学研究所 応用化学・生命工学系沼野 利佳教授の研究チームである、テクノプロR&D社の社会人博士後期課程学生の中澤 和雄(2023年3月単位取得満期退学)、菊池 洋名誉教授らは、産業技術総合研究所健康医工学研究部門の中島 芳浩グループ長との共同研究で、体内時計の針を前や後ろにずらして、朝すっきり目覚めたり、夜速やかに寝られたりするなどの作用が期待できる核酸アプタマー(Melaptと命名)の作成に成功しました。
我々の体内時計は、脳にある中枢時計が発振する約24時間の独自の概日リズムによって駆動されていますが、毎朝光を浴びることで概日リズムの時刻(位相)をリセットし、地球の明暗サイクルに同調しています。その同調機能は、網膜細胞にある青色の光受容体メラノプシンが、朝の青色の光を受容し、そのシグナルを目の神経を介して、脳の概日リズム中枢時計に伝えていることでなされています。
まず、メラノプシンを有する細胞を用いたCell-SELEX法という手法で、メラノプシンに特異的に結合するアプタマーMelaptを15種類選び出しました。昼に強く光り、夜に弱く光る約24時間周期の発光振動を示す組換え遺伝子Period2—Emerald-luciferase (Per2-ELuc)とメラノプシン遺伝子が導入されている組換え繊維芽細胞を用いて、Melaptの機能解析をしました。細胞の発する発光リズムを経時的に3日ほど観察した後、その細胞に各Melaptを添加し、同時に青色LEDライトによる光刺激を加えました。Melaptの結合により、細胞の持つ概日リズムの発光振動の位相も変化するという実験系です(Fig. 1)。
その結果、Melaptを添加せず光照射だけのコントロールでは、1時間ほどしか位相はずれませんが、明け方や夕方にMelaptを添加し光照射すると、最大で9時間までの位相の前進や後退がみられました。さらにMelaptを添加するタイミングで、位相変化の方向性が変わらなかったり、逆になったりするなど様々な性質のアプタマーが確認できました。また、光刺激しなくてもMelaptを添加しただけで位相が変化するMelaptも確認されました。
また細胞と同様に、概日リズムの時刻が、各組織の24時間周期の発光振動で観察できるPeriod1- luciferase (Per1-Luc)組換えトランスジェニック(Tg)マウスの目に、アプタマーを導入し光を照射することで、網膜から神経連絡を受ける中枢時計(視交叉上核SCN)のリズムの位相がどう変化するかを調べました。その結果、3時間までと位相差は小さくなりますが、細胞の実験で得られた位相変化とほぼ同じ結果でした。これは細胞でスクリーニングをしたMelaptが、マウスの個体レベルでも同様に機能することを示しています。
DNAアプタマーは、タンパク質などの標的物質と特異的に結合するDNA断片で、化学合成で簡単に安価に合成でき、化学修飾が容易で、抗体のように免疫原性がないなどのメリットから医薬への応用も期待されています。 今回見出されたアプタマーMelaptによって将来は、哺乳類の概日リズムの位相を3時間ほど前や後にずらすことができる可能性が示されました。
ヒトの概日リズムの周期は正確には24時間より僅かに長いため、我々は、真っ暗な環境で自由に過ごしていると、1日約30分ずつ地球の自転周期から遅れていってしまうことになります。さらに近年の携帯端末、ゲーム機器等の急速な普及を背景に、スマートフォンやパソコンの画面からブルーライトを夜に浴びることで、概日リズムの位相がずれ、睡眠障害や生活のリズムの乱れから身体・精神の不調を訴える人が増加しています。
哺乳類の概日リズムの中枢は脳内の視交叉上核(SCN)という神経核であり、そこでPeriod 1,Period 2(Per1,Per2)をはじめとする、時計遺伝子と呼ばれる遺伝子群の約24時間周期の機能発現リズムによって、自律的な概日リズムが規定され、体内に発振されています。ヒトは外界の光環境に毎朝同調することで、独自の約24時間周期の概日リズムを外界の明暗サイクルに同調させなければなりません。その同調機能で重要な役割を果たしているのが、目の奥の網膜細胞中で働く青色の光受容体メラノプシン蛋白です。朝の時間帯にメラノプシンが環境中の光に応答し、外界の光情報のシグナルを中枢時計SCNへ神経投射で伝達します。その約1時間後Per1が強く発現し、Per1発現振動リズムの位相がシフトすることで概日リズム位相がリセットされます。夜間の初期にブルーライトを見ると、SCNでPer1の強い発現が誘導され、リズム位相が後退、時刻が後ろにずれて、入眠が困難となり、不眠や体調不良をもたらします。また、休み中に就寝時間が遅くなり、休み明けに朝早く起きることは、困難を要します。これらの対策として、概日リズムへの光入力を担うメラノプシンの機能を制御することにより、概日リズムの時刻を自在にずらし、その下流の生理現象のリズムも制御・調節できるのではないかと考えました。
我々は、メラノプシン特異的なDNAアプタマーMelaptを用いたメラノプシンの機能を制御することを提案しました。まずアプタマーの利点は、タンパク質などの標的物質と特異的に結合するDNA断片で、SELEX法という人工進化の手法により、ライブラリーから容易にスクリーニングすることが可能です。また、40塩基ほどの短いDNAアプタマーであるため、安価に合成でき、化学修飾も容易で、抗体のように免疫原性がないなどのメリットから、医薬への応用も期待されています。
Per2:: ELuc::TK::OPN4 細胞に発光基質を加え培養しながら、光電子増倍管(PMT)で計測すると、約24時間周期の発光振動が観察されますが、各Melapt は この発光リズムに、様々な位相変化をもたらしました。明け方(明るくなる2時間前、CT22:Circadian Time 22)の光刺激とともにMelaptを加えると、9時間までのリズム位相を前進や後退させるものが見つかりました。また、夕方(明るくなってから8時間後、CT8:Circadian Time 8)の時刻に光刺激とともにMelaptを加えても、6時間ほどのリズム位相の前進や後退が見られました。刺激の時刻によらず、ともに時計の時刻を前進や後退に変化させる Melapt は2個、明け方と夕方で反対に変化させるものは3個あり、使い分けによる利便性が期待されます(Fig. 4,5)。
次に、Melaptは目のように青色の光で時計がリセットされる細胞では6時間ほどの大きな時刻のずれが見られましたが、マウスの個体レベルでは同様の機能を持つのかを調べました。同様に、各組織の概日リズムが発光振動で観察できるPer1-Luc組換えTgマウスの目にアプタマーを導入し、光を照射後、脳の中枢時計SCNのスライスを1週間以上培養し、SCNのリズムの位相がどう変化するか計測しました。その結果、細胞のリズム変化と同様に位相がずれ、Melaptは個体レベルでも機能すること、また、位相変化は3時間までしかずれないことがわかりました。どうしてこのような時間のずれの制限があるかということの詳細な仕組みは、まだわかっていません。
また、このアプタマーの1つの限界としては、網膜に直接作用させるためには、ドラッグデリバリーの技術がもう一段階必要なことです。これが解決できれば、目に外から点眼することによって、簡単に体内時計の時刻を調整するということが、将来はできるようになる可能性があります。
本研究は、テクノプロR&D研究費、科学研究費助成 (24K15724, 21H02083, 20H00614)、三菱財団自然科学研究助成、豊橋技術科学大学イノベーション協働研究プロジェクト研究費にて行われました。
豊橋技術科学大学敷地内にある次世代半導体・センサ科学研究所では、LSI・センサ・MEMSの設計から製作、評価まで一貫して行うことができるデバイス工場と、実験動物やバイオ実験ができるライフサイエンス実験施設を併設し、異分野の研究者間で融合研究を展開しています。将来、Melaptを網膜に注入できるようなドラッグデリバリーに使用できる微小注入針などのデバイス開発も可能です。
語句説明
アプタマー
標的タンパク質に特異的に結合する立体構造を持つ一本鎖DNAなどの核酸断片で、抗原抗体反応よりも高い親和性と特異性をもつ。核酸であるため、合成が簡単であり、近年は、核酸医薬として創薬でも注目されている。
Per2::ELuc::TK::OPN4組換え細胞
概日リズムを規定する時計遺伝子Per2プロモーター配列のあとに、概日リズムを発光振動にて可視化するため、概日リズムを発光振動にて可視化するヒカリコメツキムシ由来のルシフェラーゼコード配列を、レポーターとして連結したPer2:: ELuc のDNAと、TKプロモーターでメラノプシン(OPN4)を強く恒常的に発現させる遺伝子配列をゲノムにもつ細胞。メラノプシンを発現するため、細胞自体に青色光への感受性をもち、細胞への光照射によりPer2:: ELucの発光振動の位相がずれる。
Per1::luc組換えトランスジェニックマウス
時計遺伝子Per1プロモーター配列のあとに、ホタルルシフェラーゼコード配列をレポーターとして連結したPer1::lucは、概日リズムを発光振動にて可視化するために、Per1::luc組換え遺伝子を受精卵に注入し、全細胞に導入した組換えマウス。このマウスの脳のSCNスライスなど、個々の組織を培養することで、発光振動にて中枢時計SCNをはじめとする各組織の概日リズムを測定することができる。
Circadian Time
細胞や生物の持つ自律的な概日時計の1周期を24等分した相対的な時刻。昼の始まりを概日時刻の0時、起点時とする。CTを用いることで、サンプルの持つそれぞれのリズムの周期によって影響を受けずに、同一の概日リズムの時刻で、薬剤投与などの実験ができるようになる。
Researcher Profile

| Name | Rika Numano |
|---|---|
| Affiliation | Institute for Research on Next-generation Semiconductor and Sensing Science (IRES²) |
| Title | Professor |
| Fields of Research | Chronobiology / Molecular biology / Neuroscience |
