

Developing technology to place minute “marks” in the brain
Elucidating the functional structure of deep brain regions Kowa Koida
Graduate students Tatsuya Oikawa, Toshimitsu Hara and Kento Nomura, along with Associate Professor Kowa Koida of the Department of Computer Science and Engineering, Toyohashi University of Technology, have developed a technology capable of deploying very small "marks" in regions of the brain where activity is been recorded. These marks are created by passing a micro current through tungsten electrodes inserted in the brain to record brain activity. These marks do not damage brain tissue and can remain safely inside the brain of a living organism. This technology enables a high-resolution visualization of the brain-wide distribution of neurons with particular functional characteristics. The results of this research were published on September 11, 2023, in the online version of eNeuro.
https://www.eneuro.org/content/10/9/ENEURO.0141-23.2023
Studies involving recording the activities of deep brain regions, such as the hippocampus and thalamus, commonly utilize needle-like microelectrodes penetrating into the brain to record the electrical activity of neurons. These electrodes have the advantage of higher spatiotemporal resolution than fMRI or EEG recordings, and are capable of recording signals from the tissues of the deep brain region. However, one disadvantage of using these electrodes is that it becomes quite difficult to ascertain where exactly in the brain the electrode tip was situated after it has been removed. To address this shortcoming, a mark placement method called “marking” has been widely used. However, these existing methods have limited spatial resolution and cause damage to brain tissue. Therefore, the maximum degree of spatial precision possible with conventional experimental methods remains approximately 0.1 mm.
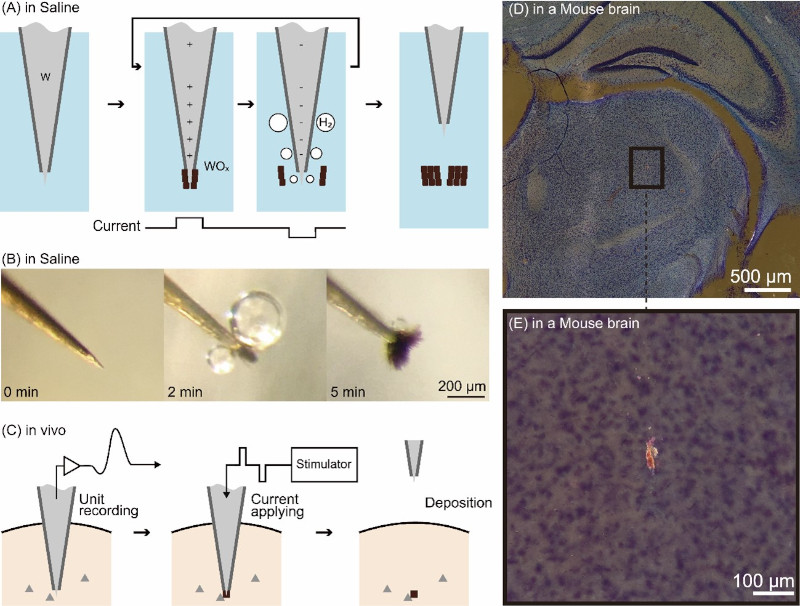
Oikawa and his colleagues focused on the electrolysis of tungsten, a metal commonly used to make the aforementioned needle-like electrodes. They developed a method wherein electrolysis was employed to deposit oxidized tungsten within the tissues of the deep brain region. When electrolyzed, the tungsten electrode generates metal oxide and hydrogen bubbles with positive and negative currents, respectively. By rapidly alternating between positive and negative currents, metal oxide is continuously generated at the tip of the tungsten electrode and then peeled off by the hydrogen bubbles, resulting in the formation of a small lump of oxide. This lump of oxide serves as a mark indicating the precise location of the electrode tip.
Oikawa and his colleagues experimented with the brains of mice and monkeys to generate minute oxide lumps (as small as 20 µm in a diameter) at the electrode tip, thus confirming that they could be deposited within the brain. They also confirmed that the current used to generate these marks, and the deposited oxides, do not damage brain tissue. Furthermore, they made the noteworthy discovery that the deposited oxides appear to glow red when stained using a standard brain tissue stain (Nissl staining) and observed under a microscope using dark-field illumination. This distinctive characteristic clearly differentiates the marks from surrounding noise, facilitating the easy identification of small markings through low-power microscopy.
Associate Professor Kowa Koida, who acted as advisor to Oikawa and his team, explained the genesis of the idea as follows:“Originally, our plan was to remove plated coatings applied in advance to the electrodes and utilize them as marks. As it happened, a mix-up occurred during experimentation, leading us to unintentionally employ an incompletely plated electrode. Surprisingly, despite this setback, we observed the formation of a mark. Upon closer consideration, we recognized that electrolysis, which is commonly used to form tungsten rod into thin needles for electrodes, produces an oxide powder. That powder can become a mark. We also realized that electrolysis can be performed in vivo. Furthermore, we found that the current parameters necessary for electrolysis can align with those employed when activating neurons through current delivered via the electrode. Essentially, the safety of the organism marked using our method has already been validated in previous experiments involving current stimulation. While it has been widely known that current stimulation results in the wear and tear of electrode tips, what remained unnoticed was that simultaneously, metal oxides are deposited in the body, serving as marks.”
Now, Oikawa and his colleagues are applying this technology to unravel the microscopic functional structure of the lateral geniculate nucleus, a visual center deep in the brain of macaque monkeys. By providing examples of effective applications of this technology, they aim to foster its widespread adoption as a fundamental technique in neuroscience.
Furthermore, this processing technique, utilizing in vivo metal electrolysis for deposition, has been used in the medical field, such as for the treatment of aneurysms using embolization coils. Therefore, electrolysis in vivo has already garnered a certain level of trust. By combining both the measurement and deposition processes into a unified technique using microelectrodes, the technologies used in this study may be applied to medical care as well.
This research is supported by the following JSPS Grants-in-Aid for Scientific Research: JP15H05917, JP19K22881, JP20K12022, JP20H00614, JP21H05820, and JP23H04348.
Reference
Oikawa T, Nomura K, Hara T, Koida K (2023) A fine-scale and minimally invasive marking method for use with conventional tungsten microelectrodes. eNeuro ENEURO.0141-23.2023.
脳内に微細な「目印」を置く技術を開発
脳深部の機能的構造の解明に向けて 鯉田 孝和豊橋技術科学大学情報・知能工学専攻の博士後期課程 及川 達也、博士前期課程 野村 健人(2020年3月修了)、原 利充(2019年3月修了)、次世代半導体・センサ科学研究所の鯉田 孝和 准教授は、脳活動を記録した場所を特定するための非常に小さな「目印」を付ける技術を開発しました。この目印は、タングステン製の電極を脳へ挿して脳活動を記録したあとに、微弱な電流を流すことで作ることができます。また、目印を付けても脳組織へダメージを与えず、生きている動物の脳内で安全に残り続けます。本技術によって、特定の機能を持つ神経細胞の脳内分布を高精細に示すことができるようになりました。本研究成果は、2023年9月11日付でeNeuroにオンライン公開されました。
https://www.eneuro.org/content/10/9/ENEURO.0141-23.2023
海馬や視床のような脳深部から脳活動を記録する研究では、針状の電極を脳に挿して、神経細胞の電気的活動を記録する方法が広く使われています。電極を挿す脳活動記録法は、fMRIや脳波測定よりも高い時空間分解能で、かつ脳深部の組織からも記録できるという利点があります。しかし、針状の電極は細くて曲がりやすく、脳は圧力で容易に変形するため、電極を抜いた後に電極の先端が脳内のどこに位置していたかわからなくなるという欠点がありました。この欠点を補うため、記録部位に目印をつける「マーキング」手法が多く開発されてきましたが、その空間精度は低く、脳組織を壊してしまうという問題がありました。そのため、従来の実験手法だと脳の微細構造は0.1 mm程度の精度でしか理解できませんでした。
そこで、及川らは電極の材料としてよく使われるタングステンの電気分解に着目し、電気分解で発生する酸化タングステンを脳内へ留置する手法を開発しました。タングステン電極は電気分解によって、プラスの電流では金属酸化物、マイナスの電流では水素の泡を発生させます。ここでプラスとマイナスの電流を早い間隔で繰り返し流し続けると、タングステン電極の先端では酸化物の発生と、泡による酸化物の剥離が起こり続け、結果として酸化物の塊が形成されます。この酸化物の塊を脳内で作ることで、電極の位置を特定するための目印となります。
及川らはマウスとサルの脳を対象に、タングステン電極の先端位置で数十 μm径の酸化物を生成し、脳内に留置可能であることを確かめました。加えて、この目印をつくるための電流と脳内に留置した酸化物が脳組織にダメージを与えないことを確認しました。さらに、脳内に留置した酸化物は、脳スライスの標準的な染色法(ニスル染色)で染色され、暗視野照明による顕微鏡観察によって赤く光ることから、生体細胞やノイズと明瞭に区別可能となることを発見しました。これによって、マイクロスケールの小さなマーキングであっても広い脳内から容易に見つけることもできます。
及川らの指導教員である鯉田孝和准教授は、以下のように言います。「当初の計画では、マーキングは電極先端に付けためっきを剥がして目印にするという方法でした。実験手順の手違いでめっきを不完全に行った電極で実験していた際に、なぜか目印が作られることに気づきました。考えてみると、タングステン電極を針状に加工するときには電気分解がよく使われており、生体内でも同じ加工ができるのは当然でした。さらに、電気分解に必要な電流電圧のパラメーターは、電極に電流を流して神経細胞を強制的に活動させる実験のものと同一にできることも分かりました。つまり、マーキングに伴う生体への安全性は、これまで行われてきた電気刺激実験で実証済みだったと言えるのです。電気刺激によって電極の先端が削れてしまうことは誰もが知っていましたが、同時に発生する金属酸化物が生体内に留置され、マーキングになるということには誰も注目していなかったようです。」
現在及川らは本技術を応用し、ニホンザル脳深部の視覚中枢である外側膝状体の微細な機能的構造を解明すべく研究を進めています。効果的な応用例となることで、脳神経科学の基礎技術として普及することが期待されます。
また、生体内で金属の電気分解と留置を応用する加工技術は、脳動脈瘤を治療する塞栓コイルなどでも医療応用されており、一定の信頼があります。本研究で利用している微細な金属電極による計測と留置を組み合わせることで、医療に応用することも期待されます。
本研究はJSPS科研費 JP15H05917、JP19K22881、JP20K12022、JP20H00614、JP21H05820、JP23H04348の助成を受けたものです。
Researcher Profile

| Name | Kowa Koida |
|---|---|
| Affiliation | Institute for Research on Next-generation Semiconductor and Sensing Science (IRES²) |
| Title | Associate Professor |
| Fields of Research | Neuroscience |
